【广告说明广告说明广告说明广告明
按时间点击量收藏量支持率猜你喜欢
点击量( )
收藏( )
推荐( )
发布时间:
【广告说明广告说明广告说明广告明
优品推荐

洛阳伊川青少年视力矫正
¥1111.00
宝丽婷克霉唑阴道片念珠菌性外阴阴道炎妇科炎症妇科用药
¥52.00
京新定坤丹6丸专治气滞血瘀月经不调调经痛经滋补气血
¥79.00
扬子江护佑黄芪精12支补血养气止汗四肢乏力口服液
¥32.00
日本进口冈本003避孕套白金超薄10片安全套男女用情趣成人
¥129.00
100贴养生艾叶贴关节腰腿颈椎护理艾灸贴热敷艾草贴正品
¥38.60
甘草片100片*3瓶装【拍下送润喉糖】甘草含片包邮药店进货
¥19.80
柔珠球避孕套珠子震动男用女情趣加长加粗带珠安全套超薄0.01
¥9.90
美国key玻尿酸尖叫魔盒情趣避孕套爽冰火g点
¥129.90
HOSEBO护踝恢复运动扭伤防护崴脚神器骨折护具固定裸关节
¥68.00
妇科千金片126片白带异常色黄小腹痛慢性盆腔炎妇科炎症
¥32.00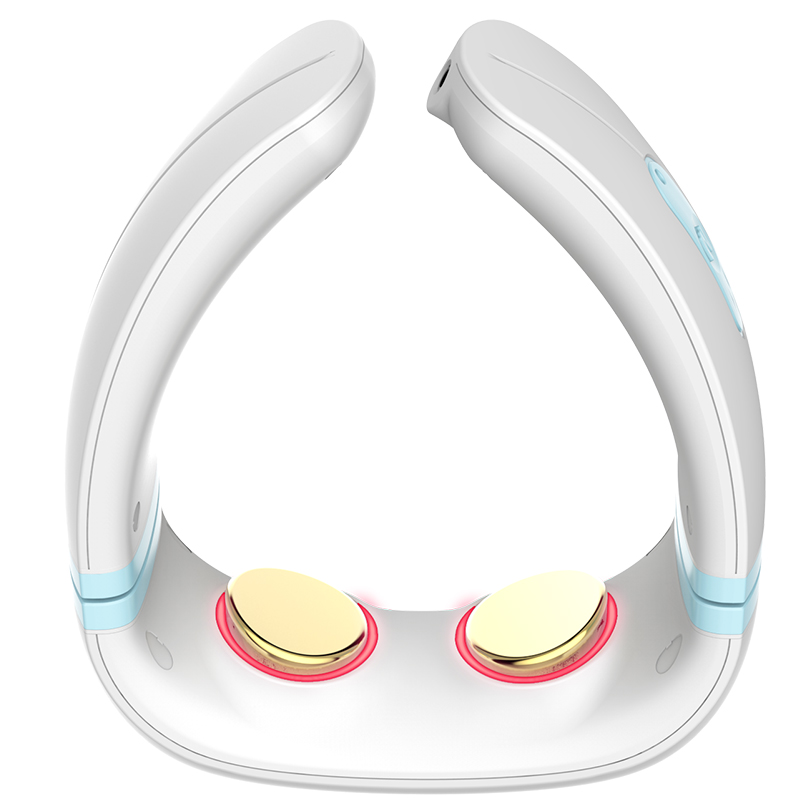
益生福颈椎按摩器颈部腰部肩部家用揉捏脖子颈肩护颈仪按摩器
¥399.00
海氏海诺碘伏/酒精消毒棉签棉棒20支(新旧包装随机发货)
¥10.90
毓婷避孕套超薄情趣高潮螺纹大颗粒安全套阴蒂刺激性用品
¥12.80
毓婷润滑剂房事女用水溶爽滑人体阴道男用润滑油情趣性用品
¥12.90
扶娃葡萄糖酸钙锌口服液10ml*36支儿童补钙补锌改善食欲口溶液
¥63.00